- Autor Jason Gerald gerald@how-what-advice.com.
- Public 2024-02-01 14:12.
- Zuletzt bearbeitet 2025-06-01 06:05.
Haben Sie schon einmal eine Flasche Wasser für ein paar Stunden in der heißen Sonne stehen gelassen und beim Öffnen ein leichtes „Zischen“gehört? Dies ist auf ein Prinzip zurückzuführen, das Dampfdruck genannt wird. In der Chemie ist Dampfdruck der Druck, den die Wände eines geschlossenen Behälters ausüben, wenn die chemische Substanz darin verdampft (in ein Gas übergeht). Um den Dampfdruck bei einer bestimmten Temperatur zu ermitteln, verwenden Sie die Clausius-Clapeyron-Gleichung: ln(P1/P2) = (ΔHDampf/R)((1/T2) - (1/T1)).
Schritt
Methode 1 von 3: Verwenden der Clausius-Clapeyron-Gleichung
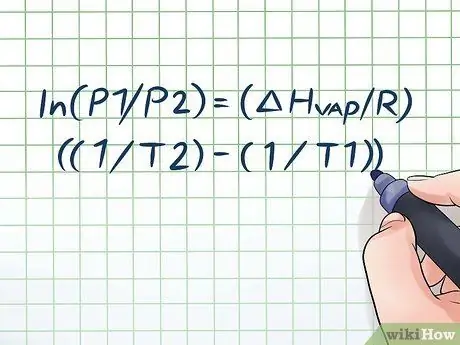
Schritt 1. Schreiben Sie die Clausius-Clapeyron-Gleichung auf
Die Formel zur Berechnung des Dampfdrucks mit der Änderung des Dampfdrucks im Laufe der Zeit heißt Clausius-Clapeyron-Gleichung (benannt nach den Physikern Rudolf Clausius und Benoît Paul Mile Clapeyron). Dies ist im Grunde die Formel, die Sie benötigen, um die meisten Arten von Problemen zu lösen Fragen zum Dampfdruck finden sich häufig im Physik- und Chemieunterricht. Die Formel lautet wie folgt: ln(P1/P2) = (ΔHDampf/R)((1/T2) - (1/T1)). In dieser Formel stehen die Variablen für:
-
hDampf:
Die Verdampfungsenthalpie einer Flüssigkeit. Diese Enthalpie ist normalerweise in der Tabelle am Ende des Chemielehrbuchs zu finden.
-
R:
Die reale/universelle Gaskonstante oder 8,314 J/(K × Mol).
-
F1:
Die Temperatur, bei der der Dampfdruck bekannt ist (oder Anfangstemperatur).
-
T2:
Die Temperatur, bei der der Dampfdruck unbekannt ist/ermittelt werden soll (oder die Endtemperatur).
-
P1 und P2:
Dampfdruck bei Temperaturen T1 bzw. T2.

Schritt 2. Geben Sie die Ihnen bekannten Variablen ein
Die Clausius-Clapeyron-Gleichung sieht kompliziert aus, weil sie viele verschiedene Variablen hat, aber es ist eigentlich nicht so schwierig, wenn Sie die richtigen Informationen haben. Die meisten grundlegenden Dampfdruckprobleme werden zwei Temperaturwerte und einen Druckwert oder zwei Druckwerte und einen Temperaturwert auflisten - wenn Sie das einmal herausgefunden haben, ist die Lösung dieser Gleichung sehr einfach.
- Nehmen wir zum Beispiel an, dass uns gesagt wird, dass wir einen Behälter voller Flüssigkeit bei 295 K haben, dessen Dampfdruck 1 Atmosphäre (atm) beträgt. Unsere Frage lautet: Wie hoch ist der Dampfdruck bei 393 K? Wir haben zwei Temperaturwerte und einen Druckwert, sodass wir die anderen Druckwerte mithilfe der Clausius-Clapeyron-Gleichung finden können. Durch Einfügen unserer Variablen erhalten wir ln(1/P2) = (ΔHDampf/R)((1/393) - (1/295)).
- Beachten Sie, dass Sie für die Clausius-Clapeyron-Gleichung immer den Temperaturwert verwenden müssen Kelvin. Sie können jeden Druckwert verwenden, solange die Werte für P1 und P2 gleich sind.

Schritt 3. Geben Sie Ihre Konstanten ein
Die Clausius-Clapeyron-Gleichung hat zwei Konstanten: R und HDampf. R entspricht immer 8,314 J/(K × Mol). Allerdings, HDampf (Verdampfungsenthalpie) hängt von dem Stoff ab, dessen Dampfdruck Sie suchen. Wie oben erwähnt, finden Sie normalerweise die Werte von HDampf für verschiedene Stoffe am Ende eines Chemie- oder Physiklehrbuchs oder online (wie zum Beispiel hier.)
-
Nehmen wir in unserem Beispiel an, unsere Flüssigkeit ist reines Wasser.
Wenn wir uns in der Tabelle die Werte von H. anschauenDampf, finden wir, dass HDampf reines Wasser beträgt etwa 40,65 KJ/mol. Da unser H-Wert in Joule und nicht in Kilojoule angegeben ist, können wir ihn in. umrechnen 40.650 J/mol.
- Wenn wir unsere Konstanten einstecken, erhalten wir ln(1/P2) = (40.650/8, 314)((1/393) - (1/295)).
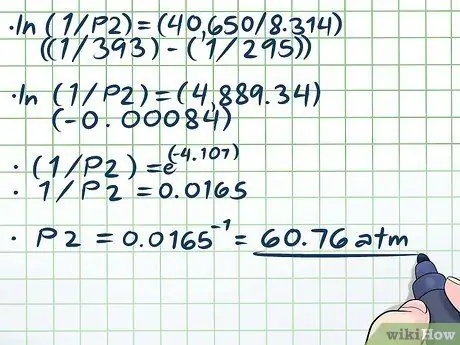
Schritt 4. Lösen Sie die Gleichung
Nachdem Sie alle Variablen außer der gesuchten in die Gleichung aufgenommen haben, fahren Sie mit der Lösung der Gleichung nach den Regeln der gewöhnlichen Algebra fort.
-
Der einzige schwierige Teil der Lösung unserer Gleichung (ln(1/P2) = (40.650/8, 314)((1/393) - (1/295))) löst den natürlichen Logarithmus (ln) auf. Um den natürlichen Logarithmus zu entfernen, verwenden Sie einfach beide Seiten der Gleichung als Exponenten für die mathematische Konstante e. Mit anderen Worten, ln(x) = 2 → eln(x) = e2 → x = e2.
- Jetzt lösen wir unsere Gleichung:
- ln(1/P2) = (40.650/8, 314)((1/393) - (1/295))
- ln(1/P2) = (4889, 34)(-0, 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0,0165
-
P2 = 0,0165-1 = 60, 76 atm.
Dies ist sinnvoll - in einem geschlossenen Behälter erzeugt eine Temperaturerhöhung auf fast 100 Grad (auf fast 20 Grad über dem Siedepunkt) viel Dampf und erhöht den Druck schnell.
Methode 2 von 3: Bestimmen des Dampfdrucks mit gelöster Lösung
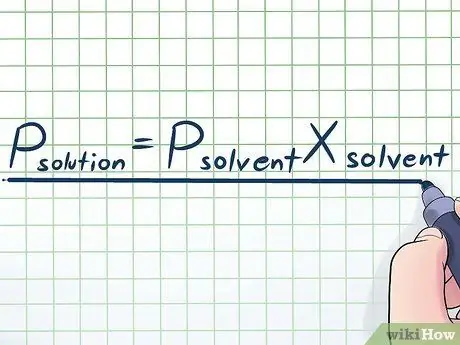
Schritt 1. Schreiben Sie das Raoultsche Gesetz auf
Im wirklichen Leben arbeiten wir selten mit einer reinen Flüssigkeit - normalerweise arbeiten wir mit einer Flüssigkeit, die eine Mischung aus mehreren verschiedenen Substanzen ist. Einige der am häufigsten verwendeten Mischungen werden hergestellt, indem eine kleine Menge einer bestimmten Chemikalie, die als gelöster Stoff bezeichnet wird, in vielen Chemikalien, die als Lösungsmittel bezeichnet werden, aufgelöst wird, um eine Lösung herzustellen. In diesen Fällen ist es nützlich, eine Gleichung namens Raoult's Law (benannt nach dem Physiker François-Marie Raoult) zu kennen, die wie folgt geschrieben ist: Pgelöst=PLösungsmittelxLösungsmittel. In dieser Formel stellen die Variablen dar;
-
Pgelöst:
Dampfdruck der gesamten Lösung (alle Elemente zusammen)
-
PLösungsmittel:
Lösungsmitteldampfdruck
-
xLösungsmittel:
Molenbruch des Lösungsmittels
- Machen Sie sich keine Sorgen, wenn Sie Begriffe wie Molenbruch nicht kennen - wir werden sie in den nächsten Schritten erklären.

Schritt 2. Bestimmen Sie das Lösungsmittel und den gelösten Stoff in Ihrer Lösung
Bevor Sie den Dampfdruck einer gemischten Flüssigkeit berechnen können, müssen Sie die verwendeten Stoffe identifizieren. Zur Erinnerung: Eine Lösung entsteht, wenn sich ein gelöster Stoff in einem Lösungsmittel auflöst - die Chemikalie, die sich auflöst, wird immer als gelöster Stoff bezeichnet, und die Chemikalie, die ihn auflöst, wird immer als Lösungsmittel bezeichnet.
- Lassen Sie uns anhand der einfachen Beispiele in diesem Abschnitt arbeiten, um die besprochenen Konzepte zu veranschaulichen. Nehmen wir für unser Beispiel an, wir möchten den Dampfdruck von Zuckersirup ermitteln. Traditionell ist Zuckersirup wasserlöslicher Zucker (Verhältnis 1:1), also können wir das sagen Zucker ist unser gelöster Stoff und Wasser ist unser Lösungsmittel.
- Beachten Sie, dass die chemische Formel für Saccharose (Haushaltszucker) C. ist12h22Ö11. Diese chemische Formel wird sehr wichtig sein.
Schritt 3. Ermitteln Sie die Temperatur der Lösung
Wie wir im Abschnitt über Clausius Clapeyron oben gesehen haben, beeinflusst die Temperatur einer Flüssigkeit ihren Dampfdruck. Im Allgemeinen gilt: Je höher die Temperatur, desto höher der Dampfdruck - mit steigender Temperatur verdampft mehr Flüssigkeit und bildet Dampf, wodurch der Druck im Behälter steigt.
Nehmen wir in unserem Beispiel an, die Temperatur des Zuckersirups beträgt an dieser Stelle 298 K (ca. 25 °C).
Schritt 4. Bestimmen Sie den Dampfdruck des Lösungsmittels
Chemische Referenzmaterialien haben in der Regel Dampfdruckwerte für viele gebräuchliche Stoffe und Verbindungen, diese Druckwerte sind jedoch meist nur gültig, wenn der Stoff eine Temperatur von 25 C/298 K oder seinen Siedepunkt hat. Wenn Ihre Lösung eine dieser Temperaturen aufweist, können Sie einen Referenzwert verwenden, aber wenn nicht, müssen Sie den Dampfdruck bei dieser Temperatur ermitteln.
- Das Clausius-Clapeyron kann helfen - verwenden Sie einen Referenzdampfdruck und 298 K (25 C) für P1 bzw. T1.
- In unserem Beispiel hat unsere Mischung eine Temperatur von 25 °C, sodass wir problemlos unsere einfache Referenztabelle verwenden können. Wir wissen, dass Wasser bei 25 °C einen Dampfdruck von. hat 23,8 mm HG

Schritt 5. Finden Sie den Molenbruch Ihres Lösungsmittels
Das Letzte, was wir tun müssen, bevor wir dies lösen können, ist den Molenbruch unseres Lösungsmittels zu finden. Den Molenbruch zu finden ist einfach: Wandeln Sie einfach Ihre Verbindungen in Mol um und ermitteln Sie dann den Prozentsatz jeder Verbindung an der Gesamtzahl der Mole in der Substanz. Mit anderen Worten, der Molenbruch jeder Verbindung ist gleich (Mol der Verbindung)/(Gesamtzahl der Mole in der Substanz).
-
Angenommen, unser Rezept für Zuckersirup verwendet 1 Liter (L) Wasser und 1 Liter Saccharose (Zucker).
In diesem Fall müssen wir die Molzahl jeder Verbindung ermitteln. Dazu ermitteln wir die Masse jeder Verbindung und verwenden dann die Molmasse der Substanz, um sie in Mol umzurechnen.
- Masse (1 L Wasser): 1.000 Gramm (g)
- Masse (1 L Rohzucker): ca. 1.056, 8 g
- Mol (Wasser): 1.000 Gramm × 1 mol/18,015 g = 55,51 mol
- Mol (Saccharose): 1.056, 7 Gramm × 1 Mol/342,2965 g = 3,08 Mol (beachten Sie, dass Sie die Molmasse von Saccharose aus ihrer chemischen Formel C12h22Ö11.)
- Gesamtmole: 55,51 + 3,08 = 58,59 mol
- Molenbruch Wasser: 55, 51/58, 59 = 0, 947
Schritt 6. Fertig
Schließlich haben wir alles, was wir brauchen, um unsere Gleichung des Raoult-Gesetzes zu lösen. Dieser Teil ist sehr einfach: Tragen Sie einfach Ihre Werte für die Variablen in die vereinfachte Gleichung des Raoult-Gesetzes am Anfang dieses Abschnitts ein (Pgelöst = PLösungsmittelxLösungsmittel).
- Wenn wir unsere Werte eingeben, erhalten wir:
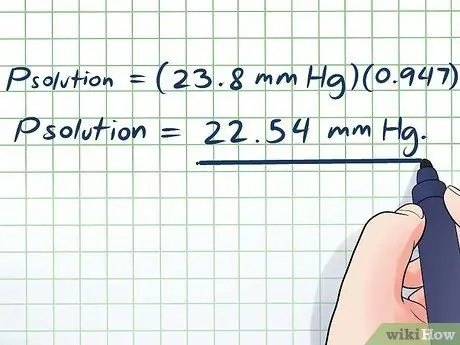
- PLösung = (23,8 mmHg)(0, 947)
-
PLösung = 22,54 mm Hg.
Das Ergebnis macht Sinn - in Mol ausgedrückt ist sehr wenig Zucker in viel Wasser gelöst (obwohl in der Praxis beide Zutaten das gleiche Volumen haben), sodass der Dampfdruck nur geringfügig abnimmt.
Methode 3 von 3: Ermittlung des Dampfdrucks in Sonderfällen

Schritt 1. Seien Sie vorsichtig mit Standardtemperatur- und Druckbedingungen
Wissenschaftler verwenden oft eine Reihe von Temperatur- und Druckwerten als einfach zu verwendenden „Standard“. Diese Werte werden als Standardtemperatur und -druck (oder STP) bezeichnet. Dampfdruckprobleme beziehen sich oft auf STP-Bedingungen, daher ist es wichtig, sich an diese Werte zu erinnern. STP-Werte sind definiert als:
- Temperatur: 273, 15K / 0 C / 32 F
- Druck: 760 mm Hg / 1 atm / 101, 325 Kilopascal

Schritt 2. Ordne die Clausius-Clapeyron-Gleichung um, um die anderen Variablen zu finden
In unserem Beispiel in Teil 1 haben wir gesehen, dass die Clausius-Clapeyron-Gleichung sehr nützlich ist, um den Dampfdruck für reine Stoffe zu bestimmen. Allerdings werden Sie nicht bei allen Fragen aufgefordert, nach P1 oder P2 zu suchen - viele werden Sie bitten, den Temperaturwert oder manchmal sogar den H-Wert zu finden.Dampf. Glücklicherweise müssen Sie in diesen Fällen die richtige Antwort einfach so umordnen, dass die Variablen, die Sie lösen möchten, auf einer Seite des Gleichheitszeichens getrennt sind.
- Angenommen, wir haben eine unbekannte Flüssigkeit mit einem Dampfdruck von 25 Torr bei 273 K und 150 Torr bei 325 K, und wir wollen die Verdampfungsenthalpie dieser Flüssigkeit (ΔHDampf). Wir können es so lösen:
- ln(P1/P2) = (ΔHDampf/R)((1/T2) - (1/T1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHDampf/R)
- R × (ln(P1/P2))/((1/T2) - (1/T1)) = HDampf Nun geben wir unsere Werte ein:
- 8, 314 J/(K × Mol) × (-1, 79)/(-0, 00059) = HDampf
- 8, 314 J/(K × Mol) × 3.033, 90 = HDampf = 25.223, 83 J/mol

Schritt 3. Berechnen Sie den Dampfdruck des gelösten Stoffes, wenn die Substanz Dampf produziert
In unserem Raoult-Gesetz-Beispiel oben übt unser gelöster Stoff, Zucker, bei normalen Temperaturen keinen Druck aus (denken Sie mal - wann haben Sie das letzte Mal gesehen, dass eine Schüssel Zucker in Ihrem Oberschrank verdampft?). verdampfen, wird dies Ihren Dampfdruck beeinflussen. Wir erklären dies, indem wir eine modifizierte Version der Gleichung des Raoult-Gesetzes verwenden: PLösung = (PVerbindungxVerbindung) Das Symbol Sigma (Σ) bedeutet, dass wir nur alle Dampfdrücke der verschiedenen Verbindungen addieren müssen, um unsere Antwort zu erhalten.
- Angenommen, wir haben eine Lösung aus zwei Chemikalien: Benzol und Toluol. Das Gesamtvolumen der Lösung beträgt 12 Milliliter (ml); 60 ml Benzol und 60 ml Toluol. Die Temperatur der Lösung beträgt 25 °C und die Dampfdrücke jeder dieser Chemikalien bei 25 °C betragen 95,1 mm Hg für Benzol und 28,4 mm Hg für Toluol. Bestimmen Sie mit diesen Werten den Dampfdruck der Lösung. Wir können dies wie folgt tun, indem wir Standardwerte für Dichte, Molmasse und Dampfdruck für unsere beiden Chemikalien verwenden:
- Masse (Benzol): 60 mL = 0,060 L &mal 876,50 kg/1.000 L = 0,053 kg = 53 g
- Masse (Toluol): 0,060 L x 866, 90 kg/1.000 L = 0,052 kg = 52 g
- Mol (Benzol): 53 g × 1 Mol/78, 11 g = 0,679 Mol
- Mol (Toluol): 52 g × 1 mol/92, 14 g = 0,564 mol
- Gesamtmole: 0,679 + 0,564 = 1,243
- Molenbruch (Benzol): 0,679/1, 243 = 0,546
- Molenbruch (Toluol): 0,564/1, 243 = 0,454
- Lösung: PLösung = PBenzolxBenzol + PToluolxToluol
- PLösung = (95,1 mm Hg) (0, 546) + (28,4 mm Hg) (0, 454)
- PLösung = 51,92 mmHg + 12,89 mmHg = 64, 81 mm Hg
Tipps
- Um die obige Clausius-Clapeyron-Gleichung zu verwenden, muss die Temperatur in Kelvin (geschrieben als K) gemessen werden. Wenn Sie die Temperatur in Celsius haben, müssen Sie sie mit der folgenden Formel umrechnen: Tk = 273 + TC
- Die oben genannten Methoden können verwendet werden, da die Energie genau proportional zur zugeführten Wärmemenge ist. Die Temperatur der Flüssigkeit ist der einzige Umgebungsfaktor, der den Dampfdruck beeinflusst.






