- Autor Jason Gerald [email protected].
- Public 2023-12-16 11:03.
- Zuletzt bearbeitet 2025-06-01 06:05.
Spektrophotometrie ist eine experimentelle Technik, mit der die Konzentration eines gelösten Stoffes in einer bestimmten Lösung gemessen wird, indem die von dieser Substanz absorbierte Lichtmenge berechnet wird. Diese Technik ist sehr nützlich, da bestimmte Verbindungen auch unterschiedliche Wellenlängen des Lichts bei unterschiedlichen Intensitäten absorbieren. Durch die Analyse des Lichts, das eine Lösung durchdringt, können Sie die in der Lösung gelösten Verbindungen und ihre Konzentrationen identifizieren. Das Werkzeug zur Analyse von Lösungen mit dieser Technik im Labor ist ein Spektrophotometer.
Schritt
Teil 1 von 3: Vorbereiten der Probe

Schritt 1. Schalten Sie das Spektralfotometer ein
Die meisten Spektralphotometer müssen aufgewärmt werden, bevor sie genaue Messungen liefern können. Starten Sie also die Maschine und lassen Sie sie mindestens 15 Minuten stehen, bevor Sie die Probe messen.
Nutzen Sie diese Zeit, um die Probe vorzubereiten

Schritt 2. Reinigen Sie die Küvette oder das Reagenzglas
In Schullabors stehen unter Umständen Einweg-Reagenzgläser zur Verfügung, die nicht erst gereinigt werden müssen. Wenn Sie jedoch eine normale Küvette oder ein Reagenzglas verwenden, müssen Sie das Gerät vor der Verwendung gründlich reinigen. Spülen Sie alle Küvetten mit entionisiertem Wasser.
- Seien Sie vorsichtig bei der Verwendung von Küvetten, da sie ziemlich teuer sind.
- Berühren Sie während der Verwendung der Küvette nicht die Seite, durch die das Licht hindurchtritt (normalerweise die klare Seite des Behälters).
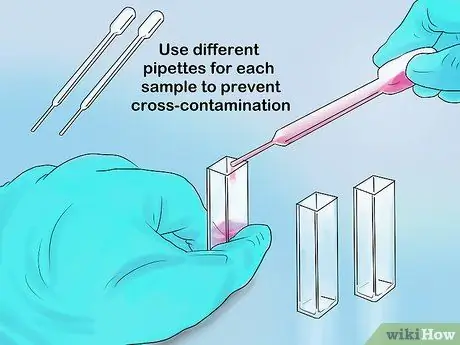
Schritt 3. Gießen Sie ausreichend Probe in die Küvette
Das maximale Volumen eines Teils der Küvette beträgt 1 ml, während das maximale Volumen des Reagenzglases 5 ml beträgt. Ihre Messungen sollten genau sein, solange das Licht des Spektralphotometers noch durch die Probe und nicht durch einen leeren Teil des Behälters hindurchtreten kann.
Wenn Sie zum Einführen von Proben eine Pipette verwenden, verwenden Sie für jede Probe eine neue Spitze. Auf diese Weise können Kreuzkontaminationen vermieden werden

Schritt 4. Bereiten Sie die Kontrolllösung vor
Diese Lösungen, die auch als Blindwert oder Blindwert bezeichnet werden, enthalten nur das Lösungsmittel in der zu analysierenden Lösung. Wenn Sie beispielsweise eine Salzprobe in Wasser gelöst haben, benötigen Sie als Blindlösung Wasser. Wenn das Wasser, das Sie verwenden, rot ist, sollten Sie auch eine rote Blindlösung verwenden. Verwenden Sie einen ähnlichen Behälter, um die Blindlösung im gleichen Volumen wie die Probe zu halten.

Schritt 5. Wischen Sie die Außenseite der Küvette ab
Bevor Sie die Küvette in das Spektralfotometer einsetzen, müssen Sie sicherstellen, dass diese sauber ist, um Störungen der Messungen durch Staubpartikel oder Verunreinigungen zu vermeiden. Entfernen Sie an der Außenseite der Küvette anhaftende Wassertropfen oder Staub mit einem fusselfreien Tuch.
Teil 2 von 3: Experimentieren

Schritt 1. Bestimmen und passen Sie die Wellenlänge des Lichts an, um die Probe zu analysieren
Verwenden Sie eine einzelne Lichtwellenlänge (monochromatischer Strahl), um die Messeffektivität zu erhöhen. Wählen Sie die Lichtfarbe, die von dem chemischen Inhalt absorbiert werden kann, von dem angenommen wird, dass er in der Testprobe gelöst ist. Stellen Sie die Wellenlänge gemäß den Spezifikationen des von Ihnen verwendeten Spektralfotometers ein.
- In Schullabors werden diese Wellenlängen in der Regel in der Versuchsanleitung angegeben.
- Da die Probe das gesamte sichtbare Licht reflektiert, unterscheidet sich die Wellenlänge der Farbe des experimentellen Lichts normalerweise immer von der Farbe der Probe.
- Ein Objekt hat eine bestimmte Farbe, weil es eine bestimmte Wellenlänge reflektiert und alle anderen Farben absorbiert. Gras erscheint grün, weil das darin enthaltene Chlorophyll Grün reflektiert und andere Farben absorbiert.
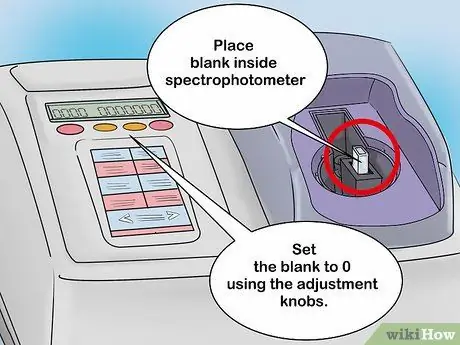
Schritt 2. Kalibrieren Sie das Spektrophotometer mit einer Blindlösung
Legen Sie die Blindlösung in den Küvettenhalter und schließen Sie das Spektrophotometer. Auf dem Bildschirm des analogen Spektrophotometers befindet sich eine Nadel, die sich je nach Intensität der Lichterkennung bewegt. Nachdem die Blindlösung eingeführt wurde, sollte sich die Nadel nach rechts bewegen. Notieren Sie diesen Wert, falls Sie ihn später benötigen. Lassen Sie die Blindlösung im Spektralfotometer verbleiben und schieben Sie dann die Nadel mit dem Einstellknopf auf Null.
- Auf die gleiche Weise können auch digitale Spektralphotometer kalibriert werden. Dieses Tool ist jedoch mit einem digitalen Bildschirm ausgestattet. Stellen Sie den Messwert der Blindlösung mit dem Drehknopf auf 0.
- Auch wenn die Blindlösung aus dem Spektralfotometer entfernt wird, ist die Kalibrierung gültig. Wenn Sie also die gesamte Probe messen, wird die Extinktion des Leerwerts automatisch reduziert.

Schritt 3. Entfernen Sie den Blindwert und testen Sie die Kalibrierungsergebnisse des Spektralfotometers
Auch nachdem die Blindlösung aus dem Spektralfotometer entfernt wurde, sollte die Nadel oder Zahl auf dem Bildschirm immer noch 0 anzeigen. Geben Sie die Blindlösung wieder in das Spektralfotometer und stellen Sie sicher, dass sich der Messwert nicht ändert. Wenn das Spektralfotometer mit einer Blindlösung richtig kalibriert ist, sollte das Ergebnis auf dem Bildschirm immer noch 0 sein.
- Wenn die Nadel oder die Zahl auf dem Bildschirm nicht 0 anzeigt, wiederholen Sie die Kalibrierungsschritte mit einer leeren Lösung.
- Wenn das Problem weiterhin besteht, suchen Sie Hilfe oder lassen Sie das Spektralfotometer von jemandem überprüfen.

Schritt 4. Messen Sie die Extinktion der Probe
Entfernen Sie die Blindlösung und geben Sie die Probe in das Spektrophotometer. Warten Sie etwa 10 Sekunden, bis sich die Zeiger stabilisiert haben oder sich die Zahlen auf der Digitalanzeige nicht mehr ändern. Notieren Sie die prozentuale Transmission und/oder Extinktion der Probe.
- Je mehr Licht durchgelassen wird, desto weniger Licht wird absorbiert. Normalerweise müssen Sie den Extinktionswert der Probe aufzeichnen, der im Allgemeinen als Dezimalzahl ausgedrückt wird, zum Beispiel 0,43.
- Wiederholen Sie die Messung jeder Probe mindestens dreimal und berechnen Sie dann den Durchschnitt. Auf diese Weise werden die Ergebnisse, die Sie erhalten, genauer.

Schritt 5. Wiederholen Sie das Experiment mit verschiedenen Lichtwellenlängen
Ihre Probe kann mehrere Verbindungen enthalten, die je nach Wellenlänge des Lichts unterschiedliche Extinktionen aufweisen. Um die Unsicherheit zu verringern, wiederholen Sie die Probenmessungen in Wellenlängenintervallen von 25 nm über das gesamte Lichtspektrum. Auf diese Weise können Sie andere gelöste Chemikalien in der Probe nachweisen.
Teil 3 von 3: Extinktionsdaten analysieren

Schritt 1. Berechnen Sie die Transmission und Extinktion der Probe
Die Transmission gibt an, wie viel Licht die Probe durchdringen und das Spektralfotometer erreichen kann. Unter Extinktion versteht man, wie viel Licht von einer der gelösten Chemikalien in der Probe absorbiert wird. Es gibt viele moderne Spektralphotometer, die Ergebnisse in Form von Transmission und Extinktion liefern. Wenn Sie jedoch einen Lichtintensitätswert erhalten, können Sie diese beiden Werte auch selbst berechnen.
- Die Durchlässigkeit (T) kann bestimmt werden, indem die Intensität des durch die Probenlösung hindurchtretenden Lichts durch die durch die Blindlösung hindurchtretende Lichtmenge dividiert wird. Dieser Wert wird normalerweise als Dezimalzahl oder als Prozentsatz ausgedrückt. T = I/I0, wobei I die Probenintensität und I0 ist die Leerintensität.
- Extinktion (A) wird als negativer Logarithmus zur Basis 10 (Exponent) ausgedrückt: A = -log10T. Wenn also T = 0, 1 ist, ist A = 1 (0, 1 ist 10 hoch -1). Das bedeutet, dass 10 % des Lichts durchgelassen werden, während 90 % absorbiert werden. Wenn T = 0,01 ist, ist A = 2 (0,01 ist 10 hoch -2). Das heißt, das durchgelassene Licht beträgt 0,1%.
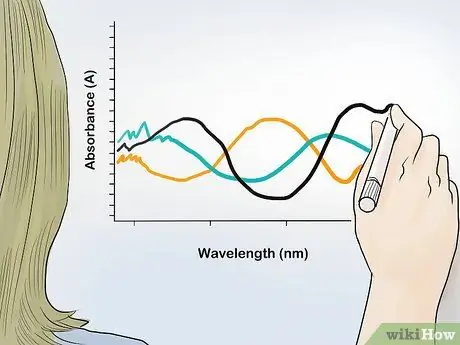
Schritt 2. Stellen Sie den Absorptionswert gegen die Wellenlänge grafisch dar
Drücken Sie den Extinktionswert als y-Achse und die Wellenlänge als x-Achse aus. Aus den Punkten aller Absorptionsergebnisse bei jeder Wellenlänge erhalten Sie das Absorptionsspektrum der Probe und identifizieren den Gehalt der Verbindung und ihr Verhältnis in der Probe.
Absorptionsspektren haben normalerweise Spitzen bei bestimmten Wellenlängen. Mit diesen Peakwellenlängen können Sie bestimmte Verbindungen identifizieren
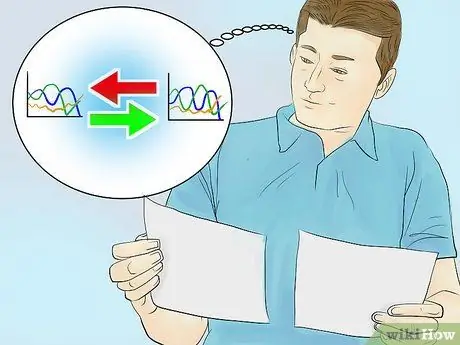
Schritt 3. Vergleichen Sie Ihr Absorptionsspektrum mit einem Diagramm einer bekannten Verbindung
Jede Verbindung hat ein einzigartiges Absorptionsspektrum und hat bei jeder Messung immer dieselbe Spitzenwellenlänge. Durch Vergleichen des erhaltenen Diagramms mit einem Diagramm einer bestimmten bekannten Verbindung können Sie den Gehalt an gelösten Stoffen in der Probenlösung ermitteln.






